
Pahami Musabab di Balik Larangan Obat Sirop, Sikapi dengan Bijak
Konten ini merupakan kerja sama dengan Kompasiana, setiap artikel menjadi tanggung jawab penulis dan tidak mewakili pandangan redaksi Kompas.com

Konten ini merupakan opini/laporan buatan blogger dan telah tayang di Kompasiana.com dengan judul "Dilema Kala Isu Gangguan Ginjal Akut dan Cemaran DEG/EG pada Produk Obat Sirop"
Persoalan obat sirop semakin gaduh dan membuat banyak masyarakat cemas sekaligus gelisah.
Hal ini berawal dari laporan puluhan anak di Gambia, Afrika Barat yang meninggal akibat Acute Kidney Injury (AKI) atau Gangguan Ginjal Akut yang diguga disebabkan oleh cemaran berlebih senyawa Dietilen Glikol (DEG) dan Etilen Glikol (EG) dalam produk obat demam/batuk berbentuk sirop.
Produk obat tersebut antara lain Promethazine Oral Solution, Kofexmalin Baby Cough Syrup, Makoff baby Cough Syrup, dan Magrip N Cold Syrup yang diproduksi oleh Maiden Pharmaceuticals Limited, India.
Berdasarkan penjelasan yang dirilis oleh BPOM RI, keempat produk tersebut maupun produk lainnya yang diproduksi Maiden tidak terdaftar dan tidak beredar di Indonesia.
Selain di Gambia, di Indonesia juga ditemukan puluhan kasus meninggalnya anak Indonesia diguda akibat gangguan ginjal misterius.
Mayoritas anak yang meninggal tersebut disebabkan oleh menurunnya fungsi ginjal dan tak sempat dapat penanganan dari rumah sakit.
Kecurigaan pun timbul apakah kasus gangguan ginjal akut pada anak-anak di Indonesia ini ada kaitannya dengan produk obat sirop seperti yang terjadi di Gambia.
Antara Tindakan Preventif vs Kebutuhan Pasien dan Kerugian Pelaku Usaha
Kementerian Kesehatan dengan sigap langsung mengambil tindakan pencegahan dengan menginstruksikan agar tenaga kesehatan pada fasilitas pelayanan kesehatan tidak meresepkan obat oral dalam bentuk cair (sirop, suspensi, drop, dan lainnya).
Hal ini tentu membuat dilema dan bingung banyak rekan sejawat yang bekerja di instalasi farmasi fasilitas kesehatan dalam menentukan jenis obat untuk bayi hingga balita. Pasalnya, obat yang biasa diberikan berbentuk oral drop (diberikan dengan cara ditetes).
Ditambah lagi apotek diminta untuk tidak menjual obat sirop. Obat sirop ini tidak hanya terbatas pada obat sirop untuk mengatasi demam/batuk/pilek atau penyakit lainnya saja.
Maka risiko selanjutnya adalah kemungkinan terjadinya kelangkaan produk obat sirop di pasar. Akibatnya, kegaduhan pun sempat terjadi.
Walau saya meyakini bahwa tindakan yang dilakukan Kemenkes tersebut tujuannya baik dan dilakukan sebagai langkah antisipasi, akan tetapi tak dapat dihindari bahwa instruksi tersebut juga menimbulkan dilema.
Secara umum, pasien yang mengonsumsi obat sirop adalah anak-anak, karena tidak semua anak bisa meminum obat dalam bentuk sediaan tablet atau kapsul, alasan lainnya karena biasanya obat sirop memiliki rasa yang manis.
Kalaupun tidak dalam bentuk sediaan sirop, anak biasanya diberikan obat dalam bentuk sediaan puyer yang dicampur dengan air. Namun, jenis obat ini juga tidak semua anak suka karena rasanya yang pahit. Ditambah lagi, tidak semua obat bisa dan boleh digerus untuk dijadikan puyer.
Beberapa obat seperti obat demam mungkin bisa diganti ke bentuk sediaan suppositoria (dimasukkan ke dalam dubur), tapi tentu tidak semua jenis obat bisa dibuat/tersedia dalam bentuk suppositoria.
Selain kerugian dari sisi pasien, para pelaku usaha di bidang produksi dan distribusi obat pun juga terpengaruh.
Produsen obat sediaan sirop pasti kalang kabut akibat instruksi dari Kemenkes tadi. Itu artinya seluruh produk sirop mereka yang sudah beredar terpaksa dihentikan sementara pada seluruh rantai distribusi.
Selain itu produk yang baru selesai diproduksi juga berpotensi menumpuk di gudang karena tidak bisa didistribusikan.
Tak hanya produsen, sarana distribusi hingga sarana ritel juga harap-harap cemas karena cash flow mereka juga pasti akan terganggu jika produk tidak bisa disalurkan.
Bisa dibayangkan betapa bingungnya para tenaga kesehatan di lapangan, masyarakat umum, dan berapa kerugian ekonomi yang mungkin terjadi.
Tak lama setelah instruksi Kemenkes tadi, tanggal 20 Oktober 2022 BPOM RI akhirnya merilis informasi terkait hasil pengawasan dan sampling yang telah dilakukan.
Ada 5 produk yang mengandung cemaran EG dan DEG yang melebihi ambang batas aman antara lain sebagai berikut.
- Termorex Sirop (obat demam), produksi PT Konimex dengan nomor izin edar DBL7813003537A1, kemasan dus, botol plastik @60 ml.
- Flurin DMP Sirop (obat batuk dan flu), produksi PT Yarindo Farmatama dengan nomor izin edar DTL0332708637A1, kemasan dus, botol plastik @60 ml.
- Unibebi Cough Sirop (obat batuk dan flu), produksi Universal Pharmaceutical Industries dengan nomor izin edar DTL7226303037A1, kemasan Dus, Botol Plastik @ 60 ml.
- Unibebi Demam Sirop (obat demam), produksi Universal Pharmaceutical Industries dengan nomor izin edar DBL8726301237A1, kemasan Dus, Botol @ 60 ml.
- Unibebi Demam Drops (obat demam), produksi Universal Pharmaceutical Industries dengan nomor izin edar DBL1926303336A1, kemasan Dus, Botol @ 15 ml.
Sesuai klarifikasi tersebut, BPOM telah meminta produsen pemilik izin edar untuk melakukan penarikan (recall) produk terkait dari seluruh sarana pada rantai distribusi, termasuk fasilitas pelayanan kesehatan.
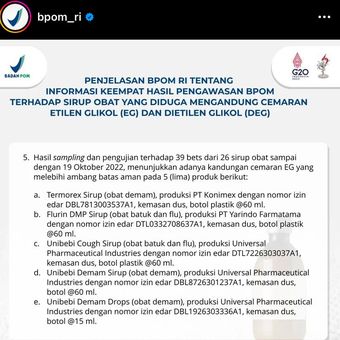 Penjelasan BPOM RI tentang Informasi Keempat Hasil Pengawasan BPOM terhadap Sirop Obat yang Diduga Mengandung Cemaran Etilen Glikol (EG) dan Dietilen Glikol (DEG)
Penjelasan BPOM RI tentang Informasi Keempat Hasil Pengawasan BPOM terhadap Sirop Obat yang Diduga Mengandung Cemaran Etilen Glikol (EG) dan Dietilen Glikol (DEG)Sekarang coba dicek lagi apakah Anda ada yag sedang menggunakan atau menyimpan obat-obat tersebut?
Bagaimana Dietilen Glikol & Etilen Glikol Ada di Produk Obat Sirop?
Sebagai informasi, Dietilen Glikol (DEG) dan Etilen Glikol (EG) tidak digunakan dalam produk obat.
DEG dan EG merupakan bahan kimia yang digunakan industri untuk pembuatan berbagai macam produk seperti resin plastik, antibeku, dan pendingin untuk otomotif.
Jika keracunan DEG atau EG akan menimbulkan beberapa efek seperti nyeri perut, sakit kepala, mual, muntah, diare, hingga gangguan ginjal akut yang berujung pada kematian.
Namun demikian, DE dan EG masih bisa muncul sebagai cemaran (impurity) dalam produk obat yang menggunakan gliserin/gliserol, sorbitol, propilen glikol, dan polietilen glikol.
Bahan-bahan ini tergolong zat tambahan yang digunakan sebagai pelarut dalam sediaan larutan oral/sirop dan tidak memberikan efek.
Pelarut ini lazim digunakan dalam formulasi obat karena tidak semua zat aktif obat bisa larut dalam air.
Nah, cemaran DEG dan EG ini dipantau dengan melakukan pengujian kadar DEG dan EG pada produk jadi obat.
Sesuai Farmakope dan standar baku yang diakui, ambang batas aman (Tolerable Daily Intake/TDI) untuk cemaran DEG dan EG adalah 0.5 mg/kg BB/hari.
Pertanyaan selanjutnya, jika DEG dan EG bisa muncul sebagai cemaran dalam produk yang menggunakan bahan pelarut sebagaimana disebutkan tadi, bagaimana kita bisa mengetahui apakah suatu produk menggunakan keempat pelarut tersebut?
Sesuai regulasi, tidak semua komposisi bahan tambahan wajib dicantumkan pada label kemasan obat. Oleh sebab itu, biasanya pada kemasan obat hanya menyantumkan zat aktif dan kekuatan dosisnya saja.
Misal "Setiap tablet mengandung Parasetamol 500 mg dan Chlorpheniramine Maleate 2 mg". Hal ini terkait rahasia dagang dan hak kekayaan intelektual atas formulasi obat dari si produsen.
Selain itu, bahan tambahan pada obat biasanya tidak memberikan efek terapi. Jadi yang paling penting untuk dicantumkan pada kemasan adalah komposisi zat aktifnya.
Meskipun tidak ikut dicantumkan dalam kemasan, seluruh komposisi zat aktif dan zat tambahan dalam formulasi obat sudah dilaporkan dan dievaluasi untuk memenuhi syarat keamanan, mutu, dan efikasi (khasiat) oleh BPOM.
Bahkan jika suatu obat telah memiliki izin edar dari BPOM dan telah dipasarkan, akan tetap ada kemungkinan produk tersebut tidak memenuhi persyaratan keamanan dan mutunya.
Oleh sebab itu BPOM juga memiliki kewajiban untuk melakukan post-market surveillance (pengawasan pasca pemasaran) untuk memantau produk-produk yang sudah beredar di pasaran.
Hal ini sekaligus menuntuk produsen obat untuk selalu konsisten dalam memastikan produk-produk yang dibuatnya sudah sesuai standar yang ditetapkan dan memenuhi persyaratan.
Lebih Cerdas dan Bijak dalam Menyebarkan Informasi dan Mengkonsumsi Obat
Informasi tentang daftar 29 produk obat cair yang ditarik dari pasaran sudah saya ketahui sebelum keluarnya klarifikasi dari BPOM.
Namun untuk menyebarkannya agar tak korban tak lagi bertambah pun tentunya tak mudah, karena masih perlu investigasi yang komprehensif mulai dari proses pengujian hingga penelusuran batch produk di sepanjang rantai distribusi.
Oleh sebab itu kita juga perlu hati-hati dan bijak dalam menyebarkan informasi, apalagi jika belum valid. Salah-salah, kita bisa dijerat UU ITE atau terlibat dalam black campaign dari pihak-pihak tertentu yang ingin menjatuhkan pihak lainnya.
Selain itu perlu juga dicatatat meski sudah ada daftar produk obat yang akan ditarik, belum tentu bahwa produk-produk itulah yang menjadi penyebab utama kasus AKI pada anak-anak.
Penyebab dan faktor risiko gangguan ginjal akut itu masih perlu diinvestigasi lebih lanjut lagi oleh para pakar beserta seluruh stake holder terkait. Jadi kita tunggu saja perkembangan selanjutnya.
Dan tanpa bosan-bosannya, saya juga terus mengingatkan kita semua untuk menjadi konsumen yang bijak dan cerdas. Sejatinya obat adalah racun, meskipun dengan dosis tertentu dapat memberikan manfaat dalam kesehatan.
Oleh sebab itu kita juga tidak boleh sembarangan membeli obat dari sarana yang tidak resmi agar terhindar dari berbagai risiko yang tak diinginkan.
Semoga akan segera ada titik terang terkait kasus obat sirop dan AKI ini sehingga dapat diambil tindakan pencegahan yang lebih tepat lagi untuk melindungi masyarakat.
Referensi:
WHO | BPOM | Cek Fakta Kompas







































